サンティン、シャイム、マカロフ、ヤギサワ、ボロディ「イベルメクチン:COVID-19という新たな世界的惨事に対する有効性が示されたノーベル賞受賞の多面的薬剤」翻訳 ver.1 (2021/8/7)
翻訳:朴勝俊(関西学院大学教授)
これは,論文が受理された後に,表紙やメタデータの追加,読みやすさのためのフォーマットの変更などを行った論文のPDFファイルですが,まだ最終的な記録ではありません。このバージョンは、最終的な出版物になるまでに、さらにコピーやタイプセット、レビューを受けることになりますが、論文の早期公開のためにこのバージョンを提供しています。制作過程において、内容に影響を与えるような誤りが発見される可能性があり、ジャーナルに適用されるすべての法的免責事項が適用されることをご了承ください。
© 2021 The Author(s). Published by Elsevier Ltd.
※原論文の参考文献のうち22番は取り下げられています。ご注意ください。
※専門外のため誤訳がありうることをご了承頂き、正確な内容は原典でご確認ください
※文末にPDF版があります

概要
2015年にノーベル生理学・医学委員会は、感染症の治療に関する60年ぶりの賞を、世界で最も壊滅的な熱帯病に対して使用されている多面的薬剤イベルメクチン(IVM)の発見に与えた。2020年3月に、新たな世界的疫病であるCOVID-19に対してIVMが初めて使用されてから、これまで20件以上の無作為化臨床試験(RCT)が入院および外来治療に対して行われてきた。2021年に報告されたIVM治療に関するRCTの、7つのメタアナリシスのうちの6つで、COVID-19による死亡者数の顕著な減少が認められており、死亡率の平均相対リスクは対照群に対して31%であった〔訳注:死亡率が3割程度に低下する〕。最大量のIVMを投与したRCTでは、対照群と比較して死亡率が92%減少した(被験者総数400名、p<0.001)。ペルーで行われた大規模なIVM治療では、最も大規模な処置が行われた10州において、30日間における過剰死亡が平均74%減少した。死者数の減少は25州すべてにおいて、IVM配布の程度と相関していた(p<0.002)。また、SARS-CoV-2などのベータコロナウイルスの2つの動物モデルにおいても、IVMによる罹患率の大幅な低下が確認された。SARS-CoV-2のスパイクタンパク質に競合的に結合することが、IVMの生物学的メカニズムであるが、これはエピトープ特異的なものはないと考えられ、新たに出現したウイルスの変異株に対しても十分な効果を発揮する可能性がある。
はじめに
2015年の、イベルメクチン(IVM)と抗マラリア薬の発見に対するノーベル賞は、感染症の治療薬を対象にしたものとしては、1952年にストレプトマイシンが受賞して以来の受賞となった[1]。多面的な効力を持つ大環状ラクトン[2,3]であるIVMは、1987年から世界中で使用され、オンコセルカ症とリンパ系フィラリア症という2つの壊滅的な熱帯病に対して大きな前進を見せた[4]。さらなる世界的な惨劇に対してIVM治療が開始されてから、1年が過ぎた。COVID-19のIVM治療が初めて実施されてから1年の間に、COVID-19のIVM治療に関する20件以上の無作為化臨床試験(RCT)の結果が報告されており[2,6,7]、25カ国でCOVID-19の入院および外来治療が行われた[2]。
IVMの発見でノーベル賞共同受賞者となった大村智博士らは最近、COVID-19に対するIVMの臨床活動を包括的にレビューし、死亡率と罹患率の大幅な低下を示す証拠が圧倒的に多いと結論付けた[2]。我々のレビューも、新たな複数の研究に関する検討を加えた上で、この結論を支持している。
SARS-CoV-2および近縁種であるベータコロナウイルスのIVM治療に関する動物実験
COVID-19に対するIVM治療の臨床結果を検討するための枠組みとして、関連する動物実験で、ヒト相当で低用量のIVMを用いたものがある。ゴールデンハムスターにSARS-CoV-2を鼻腔内接種し、COVID-19の症候性感染を引き起こしたさい、IVMを同時に投与することで臨床症状の重症度が有意に低下した(p<0.001)。ウイルス量は減少しなかったものの、無嗅覚症の発生率が3分の1になり、肺組織のIl-6とIl-10との比率が大幅に減少するなどの改善が見られた[10]。別の動物モデルでは,マウスにマウス肝炎ウイルスMHV-A59[11]を感染させた[8]。これはSARS-CoV-2やSARS-CoV,MERSと同様に,ヘマグルチニン・エステラーゼ[12]を発現しないベータコロナウイルス株である。感染マウスでは病理組織学的に重度の肝障害が見られたのに対し、IVM治療を受けたマウスでは肝ウイルス量が半分になり、肝障害も最小限に抑えられ、非感染の対照マウス群で観察されたものと有意差はなかった。
COVID-19のIVM治療および予防に関するRCT
上に引用したように、COVID-19のIVM治療に関するRCTは、現在までに20件以上行われている。2021年に登場した、COVID-19のIVM治療研究のメタアナリシスをGoogle Scholarで検索すると[13]、RCTのみから結論を導いた研究が7件あった[6,14-19]。これらのうち4件では、コクランの分析手法を用いて算出された、IVM治療群と対照群の死亡率の相対リスク(RR)は0.25~0.37で、平均は0.31であった[6,14,15,19]〔訳注:これは死亡率が約7割下がったことを意味する〕。他の3つのメタ分析では、オッズ比がそれぞれ0.16、0.21、0.33で、平均0.23であった[16-18]〔訳注:オッズ比は死亡と治癒の比率(オッズ)を、治療群と対照群で比較したものであり、この平均値は対称群と比べてオッズがおよそ4分の1に下がったことを意味する〕。これら7つのメタアナリシスのうち6つは、COVID-19の死亡率を減少させるIVMの有効性について有意[6,14-16]あるか、その可能性がある[17,18]と結論づけている。そのうち1つのメタアナリシスは、その最初のバージョン[20]ではIVMの有効性を示す証拠はないとし、IVM治療と対照のRRを1.11と報告していたが、このRR値を0.37に変更して〔括弧:死亡率が約3分の1になることを認めて〕、ひとつ研究[21]に関して治療群と対照群の死亡数を取り違えていたのを訂正した後も、同じ結論に拘泥していた[19]。これら7つのメタ分析のうちで最も新しく包括的なものは、11のRCTから得られたIVM治療群の被験者1,101人の死亡数31人と、対照群の被験者1,064人の死亡数91人の合計をプールしたものであるが、これは死亡率の67%の減少を意味当し、全体的な効果の統計的な有意性はp=0.005であった[16]。最大量のIVMを使用したRCTでは、1~4日目の各日に400μg/kgを投与したが[22]、治療群と対照群(各200人)の死亡者数は2対24で、COVID-19による死亡率は92%減少した(p<0.001)。
上記のようにCOVID-19のIVM治療の有効性を示す臨床的証拠が圧倒的に多いことに対して、2021年の時点で異議が唱えられていたのは、これらのRCTのいずれも「主流の査読付き学術誌」に掲載されていなかったためである[23]。しかし、このギャップを埋めるごとく、2021年にCOVID-19治療に関する5つのRCTが主要学術出版社の雑誌に発表された[24-28]。また2021年には、COVID-19のIVM治療に関する他の3つのRCTが発表された。そのうちの1つはIVM治療の方が、入院期間が短いことを報告したが、統計的有意性が不足している(p=0.08)[29]。IVMを他の2つの薬物治療群と比較した研究は、プラセボ群との比較は行わず、便益を認めなかった[30]。さらには、コロンビアのカリで行われた追加の研究では、以下に述べるように、治療薬とプラセボ服用の混同がみられた。
IVMの有効性を裏付けるRCTの証拠に対しては、研究の母集団が小さすぎるという反論もあった[31]。しかし、臨床試験デザインでは、効果の高い薬剤は、少ないサンプルサイズで統計的に有意な結果を得ることができ、効果の低い薬剤にはより大きな試験集団が必要となることがよく知られている[32]。例えば、上述したように、COVID-19の最大用量のIVM治療試験では、死亡率を追跡した結果、治療群と対照群の200人ずつの死亡数は2対24であり[22]、z検定のp値は0.0006であった[33]。しかし例えば、相対リスク(RR)が75%程度の薬剤の場合には、治療群と対照群で同じ統計的有意性を得るためには、それぞれ3,800人以上の被験者が必要となる[33]。大規模な研究集団は新薬の副作用(adverse effects, AE)をスクリーニングするのに有用であるが、IVMは1987年以来、世界中で37億回投与されて安全に使用されており[2,3],標準的な単回投与量である200 μg/kgよりもはるかに多い量でも許容されている[34,35].COVID-19治療のRCTでは1,500 μg/kg[36]や1,600 μg/kg[22]、3,000 μg/kg[37]の累積投与量で4日または5日にわたって使用されているが、軽度ないしは一過性の副作用がわずかに認められるのみである。
COVID-19の高用量IVM治療の安全性を確立したRCTの中には、コロンビアのカリで実施されたものがあるが、これは中央値37歳の概して軽度のCOVID-19症例を対象とし、対照群には1名の死亡者を含む[36]。この研究では、IVM 治療による統計学的に有意な症状の改善は認められなかったが、顕著な異変が報告された。すなわち、IVM 治療の高用量に特徴的な副作用が、IVM 治療群とプラセボ群でほぼ同じ割合で発生していたのである。その内容は、一過性の目のかすみ(11.3%、11.6%)や、めまい(35.6%、34.3%)などであった。これらの対照群でのIVM使用の兆候が見られたのは、試験期間中に試験地域でIVMの店頭販売が急増したためである(原典:補足表1)。さらに、38名の患者に対してIVMがプラセボと間違えて投与されていたことが、主任薬剤師が1カ月後に発見したことによって、本試験の治療群と対照群の境界に疑問が生じた(原典試験、p.3、試験プロトコル補足資料、p.43)。さらに、64人の対照患者にプラセボとしてブドウ糖生理食塩水を使用したことで盲検化が行われたが(IVMは独特の苦味がある)、代わりのプラセボ溶液の組成は特定されていなかった[38]。
以上のようなCOVID-19治療におけるIVMの有効性の知見を裏付けるものとして、予防試験においてSARS-CoV-2に対する活性が示唆された。3件のRCTでは、COVID-19患者に曝露された100人[22]、117人[39]、203人[40]のコホートにIVMを投与して予防効果を評価している。これらの研究では、いずれも週に少なくとも150 μg/kgの量のIVMを使用しており、COVID-19の発症を統計的に有意に減少させたことが報告されており、それぞれのRRは対照と比較して20%、26%、13%で、中等症および重症の発症はより大きく減少した。COVID-19の予防に関する別のRCTでは、42日間の観察期間の第1日目に、617人の被験者に12 mg(約150 μg/kg)のIVMを1回だけ投与し、他の3つの予防的投薬群では、その期間中に毎日投与を行った[41]。低容量のIVMの1回だけ投与した群は、4つの投薬群の中で最も優れた結果をもたらした。対照群と比べて、COVID-19の症状と急性呼吸器症状の両方で50%近くの、統計学的に有意な減少を示したのである。
ペルーではIVM使用時に過剰死亡が14分の1に減少し、IVM使用終了後は13倍に増加した
25カ国におけるCOVID-19のIVM治療の臨床経験は、RCTをはるかに超えるものであり、結果は要約されているが、追跡が不完全で対照群がないため、ほとんどが評価対象外とされてきた。ペルーにおける、国家的に認可された治療の記録は、注目すべき例外である[42]。ペルーの10の州で、多くの人々を対象とするCOVID-19のIVM治療がなされた。これは軍隊主導の大規模な取り組みであるMega-Operacion Tayta(MOT)によって行われ、各州で異なる日付で開始された。これらのMOT実施州では過剰死亡者数がピーク時から30日間で平均74%と急激に減少したが、これはMOT開始日と強く関係している(図1B)。ペルーの14州では、現地でIVMの配布が行われたため、ピーク時から30日間の過剰死亡数の減少率は平均53%であったが、パンデミックの第一波の際に、抑制的政策によってIVMの配布がほとんど行われなかったリマでは、30日間の過剰死亡数の減少率は25%であった。
州別の過剰死亡数の減少(絶対値)は、図1Cに示すように、IVM配布の程度(最大:MOT実施州、中程度:地域配布、最小:リマ)と相関している(ケンドールの順位相関係数 τb = 0.524、p<0.002)。全国的には、2020年12月1日までの4ヶ月間で過剰死亡数が14分の1に減少した。しかし、11月17日に就任したペルーの新大統領の下で、IVM治療を制限する政策が実施された後、12月1日から2021年2月1日までの2カ月間で死亡数が13倍に増加した(図1A)。ロックダウンや集団免疫などの潜在的な交絡因子は、Google社のコミュニティ移動データや、血清反応率、人口密度、SARS-CoV-2遺伝子変異の地理的分布などを用いて除外し、図1A以外の解析対象を年齢60歳以上に限定した。2020年7月以降、パンデミックの症例死亡数を大幅に過少報告していたことをペルー保健省が把握しているため、すべての分析においてCOVID-19の症例死亡数ではなく,過剰死亡数を用いた[43].この違いはそれ以降も、国民健康データベースにおいて、COVID-19症例死亡数と全自然死の数値に一貫して現れている[42]。
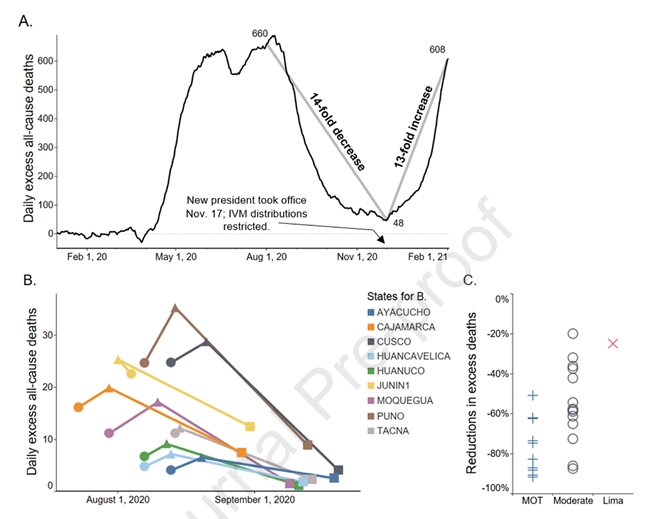
図1 A)ペルーの全国民人口における、全原因による過剰死亡(全年齢)。これらは8月1日から2020年12月1日まで14分の1に減少し、IVMの使用が制限された後は2月1日までに13倍に増加した。AとBに関して、縦軸の値(y値)は7日間の移動平均値であり、BとCは60歳以上である。データはPeru’s National Death Information System (SINADEF)によるもの。
B)軍主導の大量IVM配布プログラム「MOT作戦」が実施されたほぼ全ての州で過剰死亡者数が減少したが、Pascoは3日間しかプログラムが実施されておらず、例外である。●MOT開始日の死亡者数、▲ピーク時の死亡者数、■ピーク時から30日後の死亡者数。Juninでは、MOT開始の13日前に地元のルートでIVMを配布した。
C)25州におけるIVM配布の程度別に見た、ピーク死亡時から30日後の過剰死亡数の減少率: MOTを最大限に実施した州(+)は平均74%減、地域配布を行った州(○)は平均53%減、最小減実施地域のLima(×)は25%減であった。これらの州別減少数の絶対値は、IVM配布の程度と相関している(Kendall τb = 0.524, p<0.002(Spearman rho = 0.619, p<0.001)となった。
これらのデータはすべて、一般公開されているペルーの国家データベースから得たものであり、関連する圧縮データセットはDryadデータリポジトリから入手可能である[42]。
IVMを用いた併用療法とその他の進行中の研究
IVMと補助薬を用いた併用療法は、これまでに実施されたRCTにおいて、COVID-19に対する有効性が示されている[24,44]。IVMとドキシサイクリンと亜鉛を用いて、治療前の spO2〔訳注:パルスオキシメーターで測定する経皮的動脈血酸素飽和度〕 が 90%以下の重症・重篤な症例を治療し、24時間後のspO2のた結果は、Sabine Hazan医学博士とともに、本論文の共著者ボロディ(TJB)が報告するであろう。IVM投与後1~2日でCOVID-19の重篤な症状が顕著に改善することが、本論文の筆頭著者(サンティン、ADS)が治療した数名の患者で確認されている。また、COVID-19に対するIVMの、このような短期的な臨床効果を客観的に追跡する研究が進行中である。IVMとフルボキサミンなどの薬剤を併用した他の併用療法は、医学的研究によって有意な便益が示されているが[45]、これについては米国のFLCCCアライアンス(https://covid19criticalcare.com)が情報提供を行っている。
併用療法の治癒可能性は、消化性潰瘍に関する30年前の医学的ブレイクスルーによって実証されていた。この病因としてのヘリコバクター・ピロリ(Helicobacter pylori)の発見は、2005年にノーベル医学賞を受賞した。1990年には、Thomas J. Borody博士が、ヘリコバクター・ピロリに対する併用療法の初の臨床試験を発表し、3つの再利用可能な薬剤(亜硝酸ビスマスと2つの抗生物質)からなる3剤併用療法で96%の治癒率を達成した[46]。1990年から2015年の間にオーストラリアでは、消化性潰瘍に対してこの3剤併用療法を適時に使用したことで、18,665人の死亡を防いだと推定される[47]。1990年代後半には、消化性潰瘍の緩和薬であるタガメットとザンタックの特許が切れ、3剤併用療法が世界の標準治療となった。
結論
私たちは、COVID-19に対するIVM治療を、予防接種と相補的に世界中に拡大すべきことを、これまでのエビデンスが支持するものと考える。IVMの生物学的メカニズムとして示されている、SARS-CoV-2スパイクタンパク質との競合的結合は、レビューされているように、エピトープ特異的ではないものと考えられ、新興のウイルス変異株に対しても十分な効果が得られる可能性がある。IVMは1987年以来、37億回投与されており、標準的な投与量よりもはるかに多い投与量でも忍容性が高く[34,35]、前述のCOVID-19の高用量治療に関する3つの研究でも重篤な症状は見られなかった[34,36,37]。世界的なCOVID-19の緊急事態において、変異ウイルス株やワクチン接種の拒否、そして数ヶ月で免疫力が低下しうることが新たな課題となっているが、IVMはこのパンデミックに対して展開される治療法の、効果的な構成要素となり得るものである。
資金提供:この論文に関する資金供与はありません。
倫理的承認及び参加同意:この研究はレビューであり倫理的承認は必要ありません。
利害相反:著者のうちTJBは、IVMを含むCOVID-19の費用対効果の高い治療法の商業化を目指しているTopelia Therapeutics(カリフォルニア州ベンチュラ)の代表者の一人です。他のすべての著者は利益相反を報告していません。
参考文献
- Ergonul O, Yalcin CE, Erkent MA, Demirci M, Uysal SP, Ay NZ, et al. Who can get the next Nobel Prize in infectious diseases? International Journal of Infectious Diseases. 2016;45:88-91.
- Yagisawa M, Foster PJ, Hanaki H, Omura S. Global Trends in Clinical Studies of Ivermectin in COVID-19. The Japanese Journal of Antibiotics. 2021;74(1).
- Campbell WC. History of avermectin and ivermectin, with notes on the history of other macrocyclic lactone antiparasitic agents. Curr Pharm Biotechnol. 2012;13(6):853-865.
- Crump A, Ōmura S. Ivermectin, 'wonder drug' from Japan: the human use perspective. Proc Jpn Acad Ser B Phys Biol Sci. 2011;87(2):13-28.
- Rajter JC, Sherman MS, Fatteh N, Vogel F, Sacks J, Rajter J-J. Use of Ivermectin is Associated with Lower Mortality in Hospitalized Patients with COVID-19 (ICON study). CHEST. 2020. doi:10.1016/j.chest.2020.10.009.
- Hill A, Abdulamir A, Ahmed S, Asghar A, Babalola OE, Basri R, et al. Meta-analysis of randomized trials of ivermectin to treat SARS-CoV-2 infection. Research Square. 2021.
doi:10.21203/rs.3.rs-148845/v1. - Kory P, Meduri GU, Varon J, Iglesias J, Marik PE. Review of the Emerging Evidence Demonstrating the Efficacy of Ivermectin in the Prophylaxis and Treatment of COVID-19. American Journal of Therapeutics. 2021;28(3):e299-e318.
- Scheim DE. From cold to killer: How SARS-CoV-2 evolved without hemagglutinin esterase to agglutinate, then clot blood cells in pulmonary and systemic microvasculature SSRN. 2020 [Available from: http://ssrn.com/abstract=3706347]. Access date March 30, 2021.
- Zaidi AK, Dehgani-Mobaraki P. The mechanisms of action of Ivermectin against SARS-CoV-2: An evidence-based clinical review article. The Journal of Antibiotics. 2021. 10.1038/s41429-021-00430-5.
- Melo GD, Lazarini F, Larrous F, Feige L, Kergoat L, Marchio A, et al. Anti-COVID-19 efficacy of ivermectin in the golden hamster. bioRxiv. 2020. doi:10.1101/2020.11.21.392639.
- Arévalo AP, Pagotto R, Pórfido JL, Daghero H, Segovia M, Yamasaki K, et al. Ivermectin reduces in vivo coronavirus infection in a mouse experimental model. Scientific Reports. 2021;11(1):7132.
- Kazi L, Lissenberg A, Watson R, de Groot RJ, Weiss SR. Expression of Hemagglutinin Esterase Protein from Recombinant Mouse Hepatitis Virus Enhances Neurovirulence. J Virol. 2005;79(24):15064-15073.
- Search for papers having "ivermectin," "meta," and "COVID" OR "SARS" in the title, appearing in 2021. [Available from: https://scholar.google.com/scholar?as_q=ivermectin+meta+%28COVID+OR+SARS%29&as_epq=&as_oq=&as_eq=&as_occt=title&as_sauthors=&as_publication=&as_ylo=2021&as_yhi=2021&hl=e216 n&as_sdt=0%2C47]. Access date June 13, 2021.
- Bryant A, Lawrie TA, Dowswell T, Fordham EJ, Mitchell S, Hill SR, et al. Ivermectin for Prevention and Treatment of COVID-19 Infection: A Systematic Review, Meta-analysis, and Trial Sequential 219 Analysis to Inform Clinical Guidelines. American Journal of Therapeutics. 2021. 220 doi:10.1097/MJT.0000000000001402.
- Hariyanto TI, Halim DA, Rosalind J, Gunawan C, Kurniawan A. Ivermectin 221 and outcomes from Covid-19 pneumonia: A systematic review and meta-analysis of randomized clinical trial studies. Reviews in Medical Virology. 2021. https://doi.org/10.1002/rmv.2265:e2265.
- Karale S, Bansal V, Makadia J, Tayyeb M, Khan H, Ghanta SS, et al. A Meta-analysis of Mortality, Need for ICU admission, Use of Mechanical Ventilation and Adverse Effects with Ivermectin Use in 226 COVID-19 Patients. medRxiv. 2021. doi:10.1101/2021.04.30.21256415.
- Kow CS, Merchant HA, Mustafa ZU, Hasan SS. The association between the use of ivermectin and mortality in patients with COVID-19: a meta-analysis. Pharmacological Reports. 2021. 10.1007/s43440-021-00245-z.
- Rodriguez-Gutierrez R, Raygoza-Cortez K, Garcia-Leal M, Saenz-Flores M, Solis RC, Flores-Rodriguez A, et al. Ivermectin in the Prophylaxis and Treatment of Patients with SARS-CoV-2: A Living Systematic Review and Meta-Analysis SSRN 2021 [Available from: 233 http://ssrn.com/abstract=3802499]. Access date June 13, 2021.
- Roman YM, Burela PA, Pasupuleti V, Piscoya A, Vidal JE, Hernandez AV. Ivermectin for the treatment of COVID-19: A systematic review and meta-analysis of randomized controlled trials. 236 medRxiv. 2021. doi:10.1101/2021.05.21.21257595.
- Roman YM, Burela PA, Pasupuleti V, Piscoya A, Vidal JE, Hernandez AV. Ivermectin for the treatment of COVID-19: A systematic review and meta-analysis of randomized controlled trials 239 (version 1). medRxiv. 2021. doi:10.1101/2021.05.21.21257595v1.
- Niaee MS, Gheibi H, Namdar P, Allami A. Ivermectin as an adjunct treatment for hospitalized adult COVID-19 patients; A randomized multi-center clinical trial. Research Square. 2020. 242 doi:10.21203/rs.3.rs-109670/v1.
- Elgazzar A, Hany B, Abo Youssef S, Hany B. Efficacy and Safety of Ivermectin for Treatment and prophylaxis of COVID-19 Pandemic. Research Square. 2020. doi:10.21203/rs.3.rs-100956/v1.
- Sax PE. Ivermectin for COVID-19 — Breakthrough Treatment or Hydroxychloroquine Redux? : NEJM Journal Watch; January 4, 2021 [Available from: https://blogs.jwatch.org/hiv-id-observations/index.php/ivermectin-for-covid-19-breakthrough-treatment-or-hydroxychloroquineredux/2021/01/04/]. Access date June 13, 2021.
- Mahmud R, Rahman MM, Alam I, Ahmed KGU, Kabir AKMH, Sayeed SKJB, et al. Ivermectin in combination with doxycycline for treating COVID-19 symptoms: a randomized trial. Journal of International Medical Research. 2021;49(5):03000605211013550.
- Okumuş N, Demirturk N, Cetinkaya RA, Guner R, Avcı İY, Orhan S, et al. Evaluation of the effectiveness and safety of adding ivermectin to treatment in severe COVID-19 patients. BMC Infectious Diseases. 2021;21(1):411.
- Samaha AA, Mouawia H, Fawaz M, Hassan H, Salami A, Bazzal AA, et al. Effects of a Single Dose of Ivermectin on Viral and Clinical Outcomes in Asymptomatic SARS-CoV-2 Infected Subjects: A Pilot Clinical Trial in Lebanon. Viruses. 2021;13(6):989.
- Shahbaznejad L, Davoudi A, Eslami G, Markowitz JS, Navaeifar MR, Hosseinzadeh F, et al. Effect of ivermectin on COVID-19: A multicenter double-blind randomized controlled clinical trial. Clinical Therapeutics. 2021. https://doi.org/10.1016/j.clinthera.2021.04.007.-
- Chaccour C, Casellas A, Blanco-Di Matteo A, Pineda I, Fernandez-Montero A, Ruiz-Castillo P, et al. The effect of early treatment with ivermectin on viral load, symptoms and humoral response in patients with non-severe COVID-19: A pilot, double-blind, placebo-controlled, randomized 263 clinical trial. EClinicalMedicine. 2021. 10.1016/j.eclinm.2020.100720.
- Abd-Elsalam S, Noor RA, Badawi R, Khalaf M, Esmail ES, Soliman S, et al. Clinical Study Evaluating the Efficacy of Ivermectin in COVID-19 Treatment: A Randomized Controlled Study. Journal of Medical Virology. 2021. https://doi.org/10.1002/jmv.27122.
- Galan LEB, Santos NMD, Asato MS, Araujo JV, de Lima Moreira A, Araujo AMM, et al. Phase 2 randomized study on chloroquine, hydroxychloroquine or ivermectin in hospitalized patients with severe manifestations of SARS-CoV-2 infection. Pathog Glob Health. 2021;115(4):235-242.
- COVID-19 Scientific Advisory Group Rapid Evidence Report: Ivermectin in the Treatment and Prevention of COVID-19: Alberta Health Services; February 2, 2021 [Available from: https://www.albertahealthservices.ca/assets/info/ppih/if-ppih-covid-19-sag-ivermectin-in-treatment-and-prevention-rapid-review.pdf]. Access date June 13, 2021.
- Sakpal TV. Sample size estimation in clinical trial. Perspect Clin Res. 2010;1(2):67-69.
- Kohn M, Senyak J. Sample Size Calculators: UCSF CTSI; [updated April 29, 2021. Available from: https://www.sample-size.net/]. Access date June 15, 2021.
- Navarro M, Camprubi D, Requena-Mendez A, Buonfrate D, Giorli G, Kamgno J, et al. Safety of high dose ivermectin: a systematic review and meta-analysis. Journal of Antimicrobial Chemotherapy. 2020;75(4):827-834.
- Guzzo CA, Furtek CI, Porras AG, Chen C, Tipping R, Clineschmidt CM, et al. Safety, tolerability, and pharmacokinetics of escalating high doses of ivermectin in healthy adult subjects. J Clin Pharmacol. 2002;42(10):1122-1133.
- Lopez-Medina E, Lopez P, Hurtado IC, Davalos DM, Ramirez O, Martinez E, et al. Effect of Ivermectin on Time to Resolution of Symptoms Among Adults With Mild COVID-19: A Randomized Clinical Trial. JAMA. 2021. 10.1001/jama.2021.3071.
- Krolewiecki A, Lifschitz A, Moragas M, Travacio M, Valentini R, Alonso DF, et al. Antiviral effect of high-dose ivermectin in adults with COVID-19: a pilot randomised, controlled, open label, multicentre trial: SSRN; 2020 [Available from: http://ssrn.com/abstract=3714649]. Access date June 10, 2021.
38 Scheim DE, Hibberd JA, Chamie JJ. Protocol violations in Lopez-Medina et al.: switched ivermectin (IVM) and placebo doses, failure of blinding, ubiquitous IVM use OTC in Cali, and nearly identical AEs for the IVM and control groups: OSF Preprints; 2021 [Available from: 294 https://doi.org/10.31219/osf.io/u7ewz]. Access date June 10, 2021.
- Chahla RE, Medina Ruiz L, Ortega ES, Morales MF, Barreiro F, George A, et al. A randomized trial - intensive treatment based in ivermectin and iota-carrageenan as pre-exposure prophylaxis for COVID-19 in healthcare agents. medRxiv. 2021. doi:10.1101/2021.03.26.21254398.
- Shouman W, Hegazy A, Nafae R, Ragab M, Samra S, Ibrahim D, et al. Use of Ivermectin as a Prophylactic Option in Asymptomatic Family Close Contacts with Patients of COVID-19 (NCT number: 04422561). Journal of Clinical and Diagnostic Research. 2021;15(2):OC27.
- Seet RCS, Quek AML, Ooi DSQ, Sengupta S, Lakshminarasappa SR, Koo CY, et al. Positive impact of oral hydroxychloroquine and povidone-iodine throat spray for COVID-19 prophylaxis: An open label randomized trial. International Journal of Infectious Diseases. 2021;106:314-322.
- Chamie JJ, Hibberd JA, Scheim DE. Ivermectin for COVID-19 in Peru: 14-304 fold reduction in nationwide excess deaths, p<0.002 for effect by state, then 13-fold increase after ivermectin use restricted: OSF Preprints; 2021 [Available from: https://doi.org/10.31219/osf.io/9egh4]. Access date June 10, 2021. Associated frozen data from the Peruvian SINADEF database used in this analysis is available from the Dryad data repository at https://doi.org/10.5061/dryad.dv41ns1xr.
- Covid-19: segundo informe para actualizar cifra de fallecidos se conocerá esta semana. Andina. Agencia Peruana de Noticias. 2020 2020/07/26.
- Hashim HA, Maulood MF, Rasheed AM, Fatak DF, Kabah KK, Abdulamir AS. Controlled randomized clinical trial on using Ivermectin with Doxycycline for treating COVID-19 patients in Baghdad, Iraq. medRxiv. 2020. doi:10.1101/2020.10.26.20219345.
- Sukhatme VP, Reiersen AM, Vayttaden SJ, Sukhatme VV. Fluvoxamine: A Review of Its Mechanism of Action and Its Role in COVID-19. Frontiers in Pharmacology. 2021;12(763).
- George LL, Borody TJ, Andrews P, Devine M, Moore-Jones D, Walton M, et al. Cure of duodenal ulcer after eradication of Helicobacter pylori. Med J Aust. 1990;153(3):145-149.
- Eslick GD, Tilden D, Arora N, Torres M, Clancy RL. Clinical and economic impact of "triple therapy" for Helicobacter pylori eradication on peptic ulcer disease in Australia. Helicobacter. 2020;25(6):e12751.
48. Berndt ER, Kyle M, Ling D. The Long Shadow of Patent Expiration: Generic Entry and Rx-to-OTC Switches. In: Feenstra RC, Shapiro MD, editors. Scanner Data and Price Indexes. Chicago: Univeristy of Chicago Press; 20
※PDF版はこちら